Einige Zellen vollführen hochspezialisierte Funktionen und sind unerlässlich für die Koordination vielfältiger Prozesse: Sie regulieren den Blutzuckerspiegel durch die Produktion von Insulin oder bilden Antikörper gegen Eindringlinge, um nur zwei Beispiele zu nennen. Diesen Aufgaben können sie nur nachkommen, indem sie sich auf eine hohe Proteinproduktion spezialisieren. Das tun sie durch die so genannte unfolded protein response (UPR), ein Programm, das den Eiweißausstoß der Zellen reguliert. Fehlfunktionen dieses Programms können entscheidend zur Entstehung von Krankheiten wie Diabetes und Krebs beitragen. Forscher um Robert Ernst haben nun einen bisher unbekannten Mechanismus entdeckt, der die Aktivierung der UPR steuert: Eine Änderung der Membranfette setzt das Programm in Gang. Die Entschlüsselung dieses Mechanismus öffnet völlig neuartige Forschungsansätze für das Verständnis von Krankheiten. Die Studie ist im Fachmagazin „Molecular Cell“ erschienen.
Zellen produzieren ständig neue Proteine und Membranfette, um zu wachsen und um sich zu teilen. Im menschlichen Körper befinden sich auch viele hochspezialisierte Zellen, die wahre Exportweltmeister sind. Plasmazellen zum Beispiel produzieren Antikörper gegen Eindringlinge wie Bakterien und Viren. Wiederum andere Zellen aus der Bauchspeicheldrüse produzieren Insulin und sind essentiell für die Regulation des Blutzuckers.
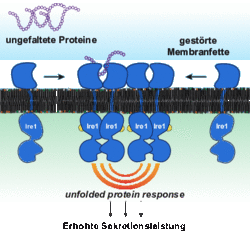
Diese Leistungen können sogenannte sekretorische Zellen nur erbringen, weil sie ihre Fähigkeit zur Produktion von Proteinen im Vergleich zu anderen Körperzellen um ein Vielfaches hochregulieren. Sie tun dies mithilfe eines zellulären Programms, der sogenannten unfolded protein response (UPR). Eine zentrale Aufgabe der UPR ist es, fehlgefaltete Proteine zu erkennen, die ihre normalen Aufgaben nicht erfüllen können. Solche fehlgefalteten Proteine sind gefährlich, da sie ähnlich einer Kettenreaktion mit anderen Proteinen verklumpen und somit Zellfunktionen stören. Die UPR erlaubt es, diese Kettenreaktion zu stoppen, indem sie hilft, die Verklumpungen aufzulösen und fehlgefaltete Proteine schnellstmöglich in ihre korrekte Form zu überführen. So trägt die UPR entscheidend zur Funktion sekretorischer Zellen bei und schützt sämtliche Körperzellen vor der Überlastung ihrer Proteinproduktion.
Es gibt aber einen Haken: Viren und Krebszellen nutzen die UPR für ihre Zwecke, um schneller zu wachsen und um das Immunsystem zu überrumpeln. Darüber hinaus können Zellen durch eine dauerhafte Aktivierung der UPR überbeansprucht werden und sterben.
Ähnlich wie ein hochgezüchteter Rennwagen, der zwar viel schneller ist als ein Traktor, produzieren Zellen, in denen die UPR aktiv ist, viel größere Proteinmengen, sind aber auch anfälliger als normale Körperzellen. Anders ausgedrückt: „Wo der Motor des Rennwagens nach 100 schnellen Runden den Geist aufgibt, weil er heiß läuft, fährt der Traktor noch viele Runden auf dem Acker gemächlich weiter, aber eben nicht so schnell wie der Rennwagen“, vergleicht Robert Ernst den Mechanismus. Warum aber eine Zelle mit hoher Produktionsleistung deutlich anfälliger ist, war bisher unbekannt.
Das Team um Professor Ernst hat dieses Rätsel jetzt gelöst und beschrieben, wie die UPR Membranfette erfühlt und darauf reagiert. In enger Zusammenarbeit mit Forschern der Goethe-Universität und dem Max-Planck-Institut für Biophysik in Frankfurt hat das Forscherteam aus der Fachrichtung Medizinische Biochemie und Molekularbiologie der Universität des Saarlandes einen neuartigen Mechanismus entdeckt, der zur Aktivierung der UPR führt und Dauerstress in Zellen auslösen kann. Demnach wird die UPR nicht nur durch fehlgefaltete Proteine aktiviert, sondern auch durch eine veränderte Zusammensetzung der Membranfette. Auf diesem Weg laufen sekretorische Zellen also Gefahr „heißzulaufen“, ganz wie der Rennwagenmotor. Die Erkenntnisse können dabei helfen, das Verständnis von Krankheiten zu verbessern. Damit stößt diese Arbeit das Fenster in eine neue Forschungsrichtung auf, das eine aktive Rolle der Membranfette berücksichtigt.
Erst seit wenigen Jahren verdichteten sich die Hinweise auf solch eine unerwartete Rolle der Membranfette durch die Beobachtungen verschiedener Arbeitsgruppen aus Japan, Großbritannien und den USA. 2011 identifizierten Peter Walter, der als Entdecker der UPR gilt, und David Ron, ein Pionier auf dem Gebiet der UPR des Menschen, die Frage nach dem Zusammenhang von Membranfetten und der UPR als das zentrale, ungelöste Rätsel – das nun gelöst wurde.
„Die unfolded protein response reguliert fünf bis zehn Prozent aller Gene im Menschen, um die Produktionsleistung einer Zelle optimieren“, stellt Robert Ernst fest. „Jetzt verstehen wir endlich, warum gerade Zellen mit einer hohen Produktionsleistung zuerst Schaden nehmen, wenn sich ihre Membranfette ändern.“ Eine Ursache dafür kann beispielsweise in der Ernährung liegen, die sich in der Zusammensetzung der Membranfette niederschlägt.
Bereits im Vorfeld der Publikation haben sich die Ergebnisse herumgesprochen, und das renommierte Journal „Nature Reviews Molecular Cell Biology“ weist in einem Editorial auf den in „Molecular Cell“ erschienenen Artikel hin: www.nature.com/nrm/journal/
Die Studie Activation of the Unfolded Protein Response by Lipid Bilayer Stress erscheint am 17. August 2017 in der Fachzeitschrift „Molecular Cell“. Online ist sie seit dem 6. Juli verfügbar. Link zur Vollversion: http://www.sciencedirect.com/
Foto: Universität des Saarlandes
CvD: Sven Herzog Saarbrücken Trier